生物化学基础理论——蛋白质(1)
大家好!我们这一篇正式进入《生物化学》的探索~
由于蛋白质在生物体内占有特殊的地位,其与核酸是构成细胞内原生质的主要成分,是最重要的生物大分子,因此我们从蛋白质开始了解生物化学。
今天我们主要认识一下合成了数万种蛋白质的氨基酸、了解一下构成蛋白质氨基酸链的连接方式以及空间构象的特点;还有蛋白质的三个基本理化性质。

大约140亿年前,宇宙是由炙热且富集能量的亚原子粒子发生催化性爆炸而产生。
在几秒之内,最简单的元素(氢和氦)被形成;然后随着宇宙的膨胀和冷却,物质在重力的作用下凝结成恒星。
一些恒星变得巨大,然后爆炸成为超新星,释放出简单的原子要核融合为复杂元素时所需的能量。
原子和分子形成旋涡状的尘埃颗粒,它们的积累最终形成岩石、小行星和行星。经过数十亿年,终而产生今日的地球以及地球上所见的化学元素。
(本段文字摘抄自《Lehninger 生物化学》

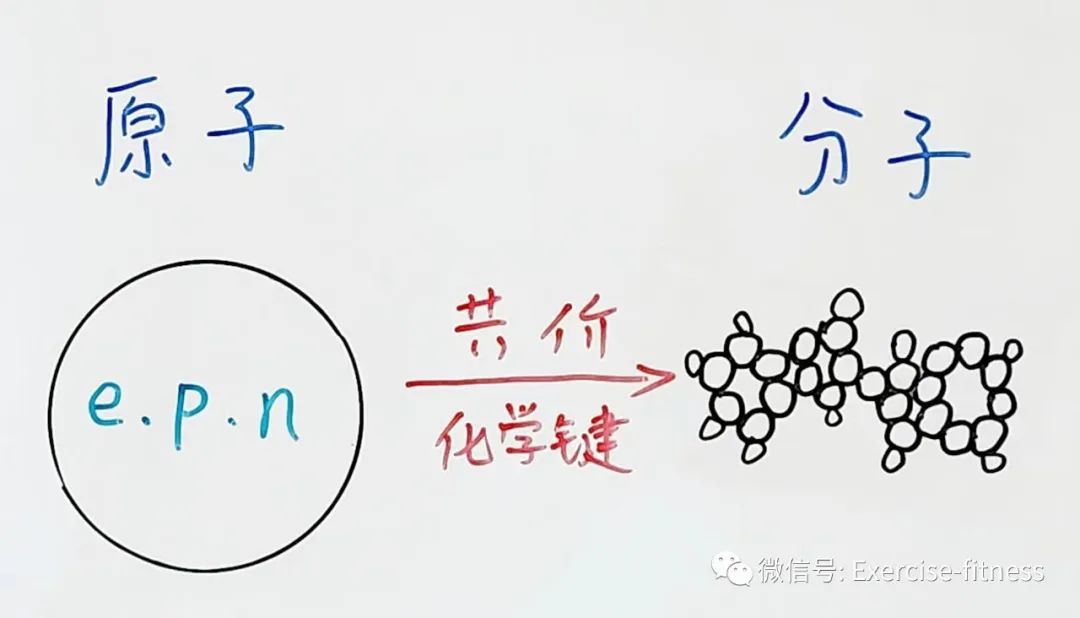
原子通过共价化学键构成分子
原子是化学反应中不可分割的最小元素;它由带一个单位的负电荷电子(e),一个单位正电荷的质子(p),以及呈电中性的中子(n)构成。
分子是两个或多个原子通过共价化学键连接起来的最小粒子;它可以是单原子分子,也可以是多原子分子的化合物。
【含碳的有机物构成了生命体】
在18世纪末,人们把这些化学元素构成的物质,分为了两大类:有机物和无机物。
有机物与无机物的根本区别是有机物构成了生命;无机物是没有生命的物质。
有机物的另一个特征是都含“碳”元素,但是含碳的元素不一定都是有机物。
【人类属于有真核细胞的有机生命体】
一切生物体都是由细胞构成的。自然界中已知的生物体形形色色,人们按照细胞把所有的生物分为“原核生物”和“真核生物”。
原核生物包括:细菌、放线菌、支原体、衣原体、蓝藻;
真核生物包含:动物、植物、真菌。
它们最主要的区别在于是否有真正的细胞核;原核生物的细胞内没有以核膜为界限的细胞核,而真核细胞内是有以核膜为界的细胞核。
我们简单做了一下铺垫:所有生物体都是由组成无生命体物质相同的原子所构成;因此,生物细胞的独特性并不是以其原子的成分来体现的,而是决定于这些原子以何种具体的形式组成为分子。
也就是说,人与无生命体一样,是由原子构成的;但是人体细胞包含了结构更加复杂的高分子(macromolecules);这些高分子往往包含了几千甚至几百万个原子。这些高分子就是构成生命体(人体)的生物大分子。

蛋白质是生命活动的物质基础,它参与了几乎所有生命活动的过程。
在细胞结构、生物催化、物质传输、转运、防御、调控以及记忆、认知等各方面都起着极其重要的作用。
蛋白质是生物体内最丰富且功能最多样性的分子。
在肌肉中,则有收缩蛋白来产生移动的动作;在骨骼中,胶原蛋白形成网状纤维结构,可供磷酸钙结晶沉积来增加骨骼的密度;在血液中,血红素、血浆白蛋白等专门负责运送蛋白质分子,是生命基本所需;而免疫球蛋白则可以对抗外来侵入的细菌与病毒。
简而言之,尽管所有的蛋白质都具有氨基酸线状聚合物的特性,但它们仍然具有多样性。
自然界已知的氨基酸超过300种,但只有20种氨基酸会构成人体的蛋白质。
氨基酸是含碳的有机酸
蛋白质是氨基酸的聚合物,氨基酸是含氮的有机酸;它包含一个中心的碳,并连接四个基团:一个羧基,一个氨基,一个氢原子,还有一个侧链。
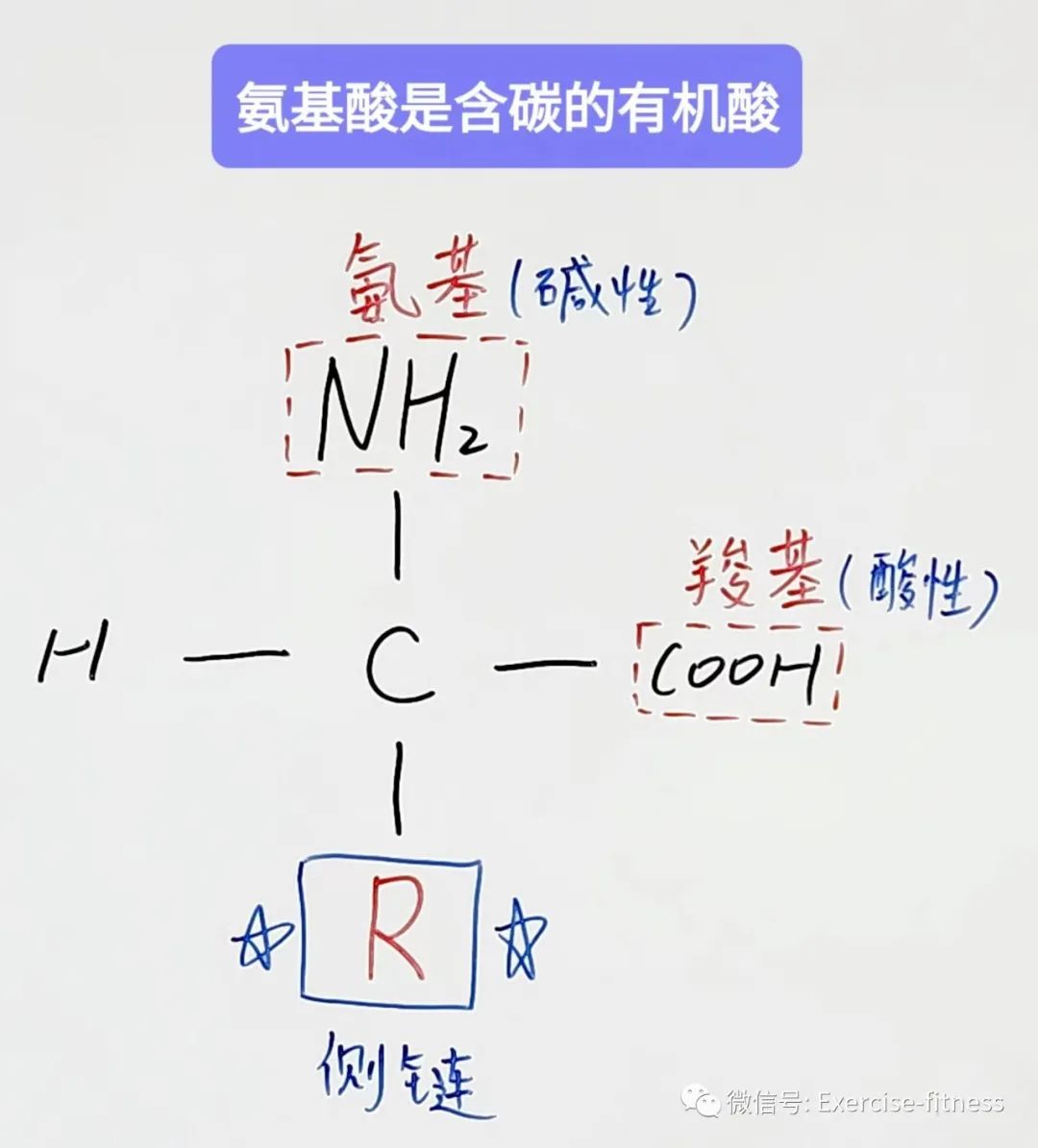
氨基酸由一个中心α碳组成,并接上一个羧基、一个氨基、一个氢原子和一个R基的侧链构成。
每一个氨基酸的身份根据其特有的R基侧链来决定;R基是包含“C”、“H”、“S”、“O”和“N”原子形成的各种组合的结构排列。
20种氨基酸可分五类
氨基酸根据功能可分为五类:非极性脂肪族氨基酸、极性中性氨基酸、芳香族氨基酸、酸性氨基酸和碱性氨基酸。
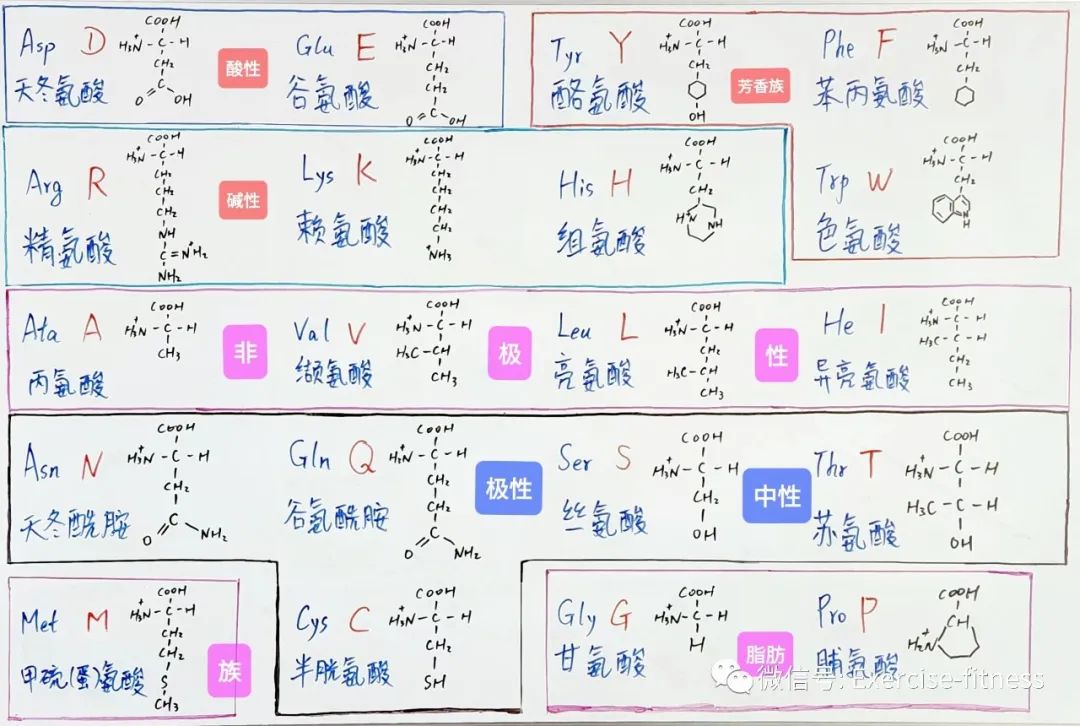
“非极性”指的是不溶于水
那么,“极性”就是溶于水的氨基酸
“脂肪族”代表这些氨基酸
含碳氢较多
“芳香族”氨基酸中都带有
“苯环”结构
人体十种必需氨基酸
肝脏是氨基酸代谢的主要器官,它是从其他蛋白质回收的氨基酸与饮食中提取的氨基酸的主要储存中心。
人体在肝脏中可以合成身体所需的60%的氨基酸;而剩下的40%需要从食物中摄取。这40%的氨基酸被称为人体的“必需氨基酸”,剩下能够合成的氨基酸被称为“非必需氨基酸”。

在必需氨基酸的每日获取当中
要根据个体差异
来摄取
蛋白质共有四级结构
蛋白质分子并不是走向随机且松散的氨基酸链;每一种天然蛋白质都有自己特定的空间结构或称为三维结构,这种三维结构通常被称作是蛋白质的构象。
为了研究的方便,把蛋白质这种三维的构象分为了四个层次,即一级结构、二级结构、三级结构和四级结构。
蛋白质的一级结构是氨基酸序列
构成蛋白质的一级结构的是组成蛋白质链的氨基酸序列。一级结构是蛋白质空间构象和特异性生物学功能的基础。
构成蛋白质的一级结构的是组成蛋白质链的氨基酸序列。一级结构是蛋白质空间构象和特异性生物学功能的基础。
连接蛋白质一级结构的化学键是肽键和二硫键。
氨基酸的序列展现了生命体的DNA基因特性,如果蛋白质的一级结构氨基酸序列出现异常,会直接导致蛋白质折叠或缺失;则会导致该生命体(如人类)患上许多遗传疾病。
蛋白质的二级结构是局域的片段
蛋白质的二级结构是指某一段肽链的局部空间结构,也就是该段肽链在主链骨架原子的相对空间位置。维持蛋白质二级结构的化学键为氢键。
氨基酸的直线序列上的某些片段中,彼此相邻的氨基酸形成规则的排列结构,有α-螺旋、β-折叠、β-转角和Ω-环,这些部分片段被称为蛋白质的二级结构。
α-螺旋有四个特点:① 螺旋的走向为顺时针方向,即“右手螺旋”;② 氨基酸侧链伸向螺旋外侧;③ 每3.6个氨基酸残基螺旋上升一圈(即旋转360°)螺距为0.54nm;④ 氢键方向与螺旋长轴基本平行。
β-折叠也有四个特点:① 呈折纸状,使多肽链形成片层结构;② 以α碳为旋转点,依次折叠成锯齿状结构,氨基酸残基侧链交替位于锯齿状结构的上下方;③ 锯齿状结构一般比较短;④ 分子内相距较远的两个肽段可通过折叠而形成相同走向,也可通过回折而形成相反走向。
β-转角常发生于肽链进行180°回折时的转角上;它通常由4个氨基酸残基组成,其第一个和第四个残基的氧可以形成氢键;其结构较特殊,第二个残基常为脯氨酸,其他常见残基有甘氨酸、天冬氨酸、天冬酰胺和苏氨酸。
Ω-环是存在于球状蛋白质中的一种二级结构。其形状像希腊字母Ω,因此得名。除了Ω-环,其余的片段基本都沿着蛋白质链的轴方向行进。Ω-环总是出现在蛋白质分子的表面(细胞膜)而且以亲水残基为主,在分子识别中可能起到重要作用。
蛋白质的二级结构还有一部分是特殊结构被称为超二级结构;这种超二级结构被称为“模体”。模体是蛋白质分子中具有特定空间构象和特定功能的结构成分。
其形式包含二级结构中α-螺旋、β-折叠、β-转角和链之间的互相组合:①α-螺旋-β-转角-α-螺旋(模体);② 链-β-转角-链(模体);③ 链-β-转角-α-螺旋-β-转角-链(模体)。
最稳定的是蛋白质的三级结构
蛋白质整条链倾向于进一步折叠成一个三维空间的紧凑结构,被称为是蛋白质的三级结构。它是指整条肽链中全部氨基酸残基的相对空间位置,也就是整条肽链所有原子在三维空间的排布位置。
维持蛋白质的三级结构的化学键主要是疏水键、盐键、氢键和范德华力(分子间的一种作用力)。
三级结构是蛋白质最稳定的形式;因为它优化了蛋白质链上不同位置氨基酸之间的吸引力。而且三级结构也是蛋白质最具有生物活性的形式。
三级结构是每一个蛋白质链的固定结构;但不一定每一个蛋白质都有四级结构。
蛋白质的四级结构由多个三级结构组成
含有两条或两条以上的多肽链,彼此连接起来,形成具备生物活性的复合体;这些多肽链都已形成稳定的三级结构,这个整体结构被称为是蛋白质的四级结构。
蛋白质的四级结构的每一条肽链的完整三级结构被称为是亚基;亚基与亚基之间呈特定的三维空间排布,并以非共价键相连接。
对于2个以上的亚基结构的蛋白质,单一亚基一般没有生物学功能,完整的四级结构是其发挥生物学功能的基础。
维持蛋白质四级结构的化学键主要是氢键和离子键。
对于2个以上的亚基结构的蛋白质,单一亚基一般没有生物学功能,完整的四级结构是其发挥生物学功能的基础
氨基酸的连接——肽键与化合键
由一个氨基酸的α-羧基与另一个氨基酸的α-氨基,脱水缩合而形成的化学键,被称为“肽键”;它是一种特殊的“酰胺键”,被公认为蛋白质分子中氨基酸连接的基本方式。
在蛋白质的一级、二级、三级和四级结构中的化学键包含了氢键、离子键、二硫键、疏水键及范德华力。
肽键
最简单的肽,由两个氨基酸组成,其中含一个肽键。由2个、3个、多个(3~10个)或许多个氨基酸单位构成的聚合物,分别被称为二肽、三肽、寡肽和多肽。多肽是氨基酸的线性多聚物,而构成肽的单个氨基酸分子因为脱水缩合而基团不全,被称为氨基酸残基。
氢键
氢键的形式常见于连接在一电负性(是元素的原子在化合物中吸引电子的能力的标度)很强的原子上的氢原子,与另一电负性很强的氧原子之间。
氢键在稳定蛋白质的空间结构上起着重要的作用;但键能较低,容易被破坏。
离子键
离子键是由带正电荷的基团与带负电荷的基团之间相互吸引之后形成的化学键。
在近中性环境中,蛋白质分子中的酸性氨基酸残基侧链电离后带负电荷,而碱性氨基酸残基侧链电离后带正电荷,二者之间可形成离子键。
二硫键
二硫键是连接不同肽链或同一肽链中,两个半胱氨酸残基的巯基基团发生氧化反应形成的共价键,具有链内二硫键和链间二硫键两种形式。
由于二硫键S-S比碳碳键C-C和碳氢键C-H弱40%左右,在许多分子中,二硫键往往是弱键。
疏水键
疏水键是多肽链上的某些氨基酸的疏水基团或疏水侧链(非极性侧链),由于避开水而造成相互接近、粘附聚集在一起的化学键。如:Leu亮氨酸、Iie异亮氨酸、Val缬氨酸、Phe苯丙氨酸等侧链基团。
范德华力
极简主义(Minimalism)并不局限于艺术或设计,它是极简主义者(Minimalist)奉行的一种哲学思想,价值观以及生活方式--“极简主义”生活方式。
蛋白质基本的三种理化性质
蛋白质的理化性质很多,我们就简单能够理解的三个性质做一个了解,即蛋白质的两性解离性质、蛋白质的胶体性质以及蛋白质的空间结构的改变会导致蛋白质的功能丧失。
蛋白质具有两性解离的性质
蛋白质氨基酸侧链中的某些基团,在不同的PH酸碱值的溶液中,可解离成正离子或负离子,因此,蛋白质分子即可带有正电荷,又可带有负电荷;这种性质被称为蛋白质的两性解离。
当蛋白质溶液处于某一PH值,蛋白质解离成正、负离子的趋势相等,即成为兼性离子,净电荷为0;此时溶液的PH值称为蛋白质的等电点(PI)。
当蛋白质溶液的PH值大于等电点PI时,蛋白质带负电荷;当蛋白质溶液的PH值小于等电点PI时,蛋白质带正电荷。因此,在人体内蛋白质的等电点大多接近于PH5.0,在体液PH7.4的环境下,会解离成阴离子。
蛋白质具有胶体性质
蛋白质能够形成胶体状,而不会在溶液中沉淀或析出,是由于稳定其胶体状态的两个因素:胶体颗粒带有表面电荷及带有水化膜。
水化膜是胶粒表面的亲水性物质通过永久偶极和氢键的作用,使乳清中的水分子在胶粒表面形成的一层定向排列物。
蛋白质的空间结构被破坏,会导致变性
在某些物理和化学因素作用下,蛋白质特定的空间构象被破坏,有序的空间构象变成无序的空间结构,从而导致其理化性质的改变和生物学活性(功能)的丧失,被称为蛋白质的变性。
变性因素包含加热(例如:发烧)、乙醇、强酸、强碱、重金属离子及生物碱试剂。
蛋白质变性后,可导致溶解度降低,黏度增加、结晶能力消失、生物学活性丧失及易被蛋白酶水解(容易被消化)等。
重点是:此种蛋白质的变性不涉及一级结构的破坏;只限于二硫键和非共价键的破坏。
2023
。
今天我们学习的内容偏重于对概念的认识;包括氨基酸根据其性质可分为的五类,氨基酸对于人体的需求时怎样的分别;以及氨基酸链的连接方式,构成蛋白质的空间构象能够为蛋白质带来功能作用,和蛋白质的理化性质。
通过今天的学习,我们对蛋白质在生物化学领域里的神秘作用和性质有了初步的认识,期待下次我们一起探索蛋白质的世界。
END

往
期
文
章
往期回顾
01
极简主义
断舍离,第一步就从整理私人空间开始
02
极简主义
断舍离,第一步就从整理私人空间开始
03
极简主义
断舍离,第一步就从整理私人空间开始
壹伴编辑器

相关阅读
-

原子是化学反应中不可分割的最小元素;它由带一个单位的负电荷电子(e),一个单位正电荷的质子(p),以及呈电中性的中子(n)构成。...
-

由于第五轮学科评估结果未向社会公布,本文为大家整理的是青海大学第四轮学科评估结果,算是目前比较权威的学科排名数据了,有比较高的参考价值,希望对大家有所帮助。...
-

杨绛:一个女人最重要的能力,不是把自己打扮得多么漂亮,也不是赚钱有多么厉害,而是无论发生任何事情,都有快乐起来的能力
有段时间,她心情特别烦闷,干什么都提不起精神。一次她的好朋友邀请她去家中做客。这位朋友家里面积虽然不是很大,但收拾得很干净,每样东西都分门别类放得整整齐齐,房间看上去温馨有序......
-

混迹所谓的文坛十多年,东奔西走,南来北往,在文学的大红横幅下,我参加过这样那样的一些研讨会、颁奖会,上过这样那样的一些研修班、培训班。耳闻目睹,...
-

对于初二学生们来说,本学期并不轻松,尤其是物理这门学科,学习了中考物理试卷中占分值最高的力学知识,囊括了三种性质的力、压强、浮力、杠杆、滑轮、斜...
-
中国正在打破西方对现代化标准垄断,探索出一条不同于西方的社会主义现代化新路,创造属于自己的发展经验,为现代化理论作出重要贡献。...
-

由于第五轮学科评估结果未向社会公布,本文为大家整理的是青海大学第四轮学科评估结果,算是目前比较权威的学科排名数据了,有比较高的参考价值,希望对大家有所帮助。...
-

混迹所谓的文坛十多年,东奔西走,南来北往,在文学的大红横幅下,我参加过这样那样的一些研讨会、颁奖会,上过这样那样的一些研修班、培训班。耳闻目睹,...
-

对于初二学生们来说,本学期并不轻松,尤其是物理这门学科,学习了中考物理试卷中占分值最高的力学知识,囊括了三种性质的力、压强、浮力、杠杆、滑轮、斜...
-

每日分享考研专业课参考书电子版及教辅资料...
-

甘薇与贾跃亭传婚变后首发声;阿里233亿元增持菜鸟;创业板再融资取消连续两年盈利条件 | 邦早报
点此收听更多音频版早报【证监会:取消创业板公开发行股票连续盈利两年的条件】11月8日,证监会新闻发言人常德鹏...
发表评论
版权声明:本文内容由互联网用户自发贡献,该文观点仅代表作者本人。本站仅提供信息存储空间服务,不拥有所有权,不承担相关法律责任如发现本站有涉嫌抄袭侵权/违法违规的内容,请发送邮件举报,一经查实,本站将立刻删除。

